Salah
satu ciri penting dari logam transisi ialah kemampuannya membentuk kompleks atau
senyawa koordinasi, dimana atom atau ion logam pusatnya mempunyai dua atau lebih
ligan terikat padanya oleh ikatan kovalen koordinat. Senyawaan demikian mungkin
berupa sebuah ion kompleks dengan ion-ion tergabung yang bermuatan berlawanan
dengannya, atau mungkin berupa sebuah kompleks yang netral. Suatu ligan dengan
lebih dari satu titik lekat kepada ion atau atom pusatnya, disebut zat penyepit
(Keenan, 1992).
Senyawa
kompleks sudah sejak lama dimanfaatkan untuk berbagai kepentingan. Beberapa
penggunaan praktis senyawaan koordinasi yang paling tua, adalah yang disebabkan
oleh warnanya. Berdasarkan kesenian dan praktek yang berasal dari zaman kuno,
pada ahli kimia dan ahli kesenian dan kerajinan merumuskan zat-zat pewarna,
kaca berwarna, dan glasir untuk keramik dari zat-zat yang sekarang diuraikan
menurut kimia koordinasi logam transisi.
Jumlah
dan jenis aplikasi kimia koordinasi atau senyawa kompleks sangat luas meliputi
kehidupan rumah tangga, industri sampai kesehatan. Dalam tulisan ini akan
dibahas mengenai aplikasi atau penggunaan senyawa kompleks atau senyawa
koordinasi dalam industri, kimia analitik dan kesehatan.
Beberapa aplikasi atau penggunaan senyawa
koordinasi atau senyawa kompleks yaitu dalam dunia industri, kimia analitik dan kesehatan.
A. Dalam
Industri
1. Proses
Fotografi
Film
foto pada dasarnya merupakan emulsi perak bromide dalam gelatin. Bila film terkena
cahaya, butiran perak bromida teraktifkan sesuai dengan tingkatan cahaya yang mengenainya.
Jika film sudah terkena cahaya ini diletakkan pada larutan pengembang
(pereduksi lemah, misalnya hidrokuinon C6H4(OH)2,
butir perak bromide yang teraktifkan membentuk logam perak bromide hitam.
Butir-butir yang tidak teraktifkan pada bagian yang tidak terkena cahaya tidak
berpengaruh. Hal ini ini menghasilkan bayangan foto.
Proses
fotografi inibelum selesai, butir-butir perak bromide yang tak teraktifkan dapat
tereduksi menjadi logam perak hitam bila terkena cahaya. Bayangan film harus
difikasi (diikat). Hal ini menyebabkan logam perak hitam yang dihasilkan dari
pengembangan melekat pada film dan perak hitam yang dihasilkan dari
pengembangan melekat pada film dan perak bromide sisa dihilangkan (dicuci).
“pengikat” yang digunakan umumnya adalah Natrium tiosulfat. Pada proses
pengikatan ini., AgBr (p) dilarutkan dan ion perak kompleks tercuci.
AgBr
(s) +
2 S2O32- → [Ag(S2O3)2]3- + Br-
2. Penyepuhan
Larutan elektrolit yang
digunakan pada penyepuhan komersial amat rumit komposisinya. Setiap komponen
memainkan peranan dalam pembentukan hasil akhir berupa penyepuhan yang halus
dan mengkilat. Beberapa logam, misalnya, tembaga, perak dan emas, umumnya
disepuhkan dari larutan ion kompleks siano. Pada reaksi elektrolisis di bawah
ini obyek yang disepuh dibuat sebagai katode dan batang tembaga sebagai anode.
Anode : Cu +
4CN- → [Cu(CN)4]3- + e-
Katode: [Cu(CN)4]3- + e- → Cu + 4 CN-
Perubahan bersih secara
sederhana mencakup pemindahan logam tembaga Cu dari ion kompleks [Cu(CN)4]3-.
Keuntungan lain dari penyepuhan tembaga Cu dari larutan [Cu(CN)4]3-.
Keuntungan lain dari penyepuhan tembaga Cu dari larutan [Cu(CN)4]3-
ialah pembentukan 1 mol tembaga per
Faraday, bukan ½ mol per Faraday jika digunakan larutan Cu2+.
3. Pengasingan
Ion Logam
Ion
logam dapat berlaku sebagai katalis reaksi-reaksi yang tak dikehendaki pada
proses industry, atau dapat mengubah sifat-sifat bahan dalam proses industri.
Sehingga, dianggap penting untuk membersihkan air dari logam-logam pengotor.
Logam pengotor ini, misalnya Cu2+, biasanya hanya terdapat dalam
jumlah kecil. Pengendapan ion logam ini dari larutan dapat dilakukan bila Ksp
pengendapannya sangat kecil.
Salah satu metode pengolahan air melibatkan
pengkelatan. Pengkelat yang banyak dipakai ialah garam asam
ETILENDIAMINTETRAASETAT (EDTA), misalnya garam natriumnya.
Gambar
1. Garam natrium EDTA
Sebagai
gambaran, tetapan pembentukan [Ca(EDTA)]2- dan [Mg(EDTA)]2-
cukup besar (Kf= 4 x 1010 dan 4 x 108) sehingga
konsentrasi Ca2+ (aq) dan Mg2+ (aq)
dapat diturunkan ke titik dimana ion ini tidak mengendap jika ditambahkan
pereaksi umum, seperti sabun (Petrucci, 1987).
1. Pencegahan
dan pemecahan kerak yang dibentuk oleh logam
Ligan
Heksadentat EDTA merupakan zat pengelat yang mempunyai afinitas yang sangat
kuat terhadap ion-ion logam tertentu dan dapat mengasingkan (sequester) ion-ion tersebut secara
efektif dalam larutan (Oxtoby, 2003). Mekanisme pencegahan kerak meliputi Chelating, sequestration, complexation,
antiprecipitation, protective colloid, threshold treatment, dispersan,
deflocculant, antinucleation, dan lain-lain. Chelation adalah pembentukan senyawa kompleks dari ion logam dengan
mengunakan molekul organic atau anorganik, senyawa kompleks tersebut dapat
terlarut atau tak terlarut. Sequestration
didefinisikan sebagai pembentukan senyawa kompleks terlarut dari suatu
logam. Sequestering agent yang biasa dipakai antara lain nitrilotriacetic acid (NTA), ethylene
diamine tetraacetic (EDTA), hydrotyethyl
ethylene diamine triacetic acid (HEDTA), dan lin-lin. Bila sequestering agent ditambahkan ke dalam
larutan yang mengandung ion logam maka senyawa kompleks akan terbentuk,
pembentukan kerak tidak terjadi karena ion logam telah terkomplekkan. Senyawa
kompleks tersebut mempunyai nilai stabilitas tertentu, yang dinyatakan dalam
konstanta stabilitas kation yang terkomplekkan. Bila ada dua atau lebih ion
logam dalam larutan sebagaimana yang terjadi pada air alam, terdapat rekasi
kompetisi terhadap sequestering agent.
Reaksi pembentukan senyawa kompleks antara ion logam dan sequestring agent merupakan reaksi setimbang, dipengaruhi oleh
beberapa factor antara lain pH, temperature, jenis dan konsentrasi padatan
terlarut, dan lain-lain. Banyak kation dapat dikomplekkan pada suatu kondisi
tetap.
Sequestring agent
jenis EDTA atau NTA saat ini banyak digunakan khususnya dalam pengolahan air boiler. EDTA dan NTA membentuk senyawa
kompleks yang stabil dengan banyak kation pengganggu pembentuk kerak dan
deposit seperti Ca2+, Mg2+, Fe3+, Fe2+,
Cu2+, dan lain-lain. Bila dalam larutan terdapat beberapa kation dan
konsentrasi molar dari sequestering agent
melebihi nilai total konsentrasi molar ion-ion logam, bahan tersebut akan
membentuk kompleks dengan ion logam yang memiliki afinitas yang lebih kuat.
Afinitas ion-ion logam terhadap sequestering
agent EDTA mempunyai nilai yang berbeda dan besarnya sesuai dengan urutan
sebagai berikut:
Na+
< Ba2+ < Mg2+ < Ca2+ < Fe2+
< Cu2+ < Fe3+
Jadi EDTA akan
membentuk senyawa kompleks lebih besar dengan ion kalsium dari pada dengan ion
magnesium, juga lebih besar dengan Fe2+ dari pada dengan ion
kalsium. Reaksi pembentukan kompleks ion logam dengan EDTA mengikuti persamaan
sebagai berikut :
4M+ + H4EDTA
↔ M4-EDTA + 4H+
Untuk pengkomplekan setiap satu ppm ion
magnesium dibutuhkan EDTA sebanyak 12 ppm, dan untuk pengomplekkan setiap 1 ppm
ion kalsium diperlukan EDTA sebanyak 7,4 ppm, seperti yang ditunjukkan oleh
tabel 2.
Tabel 2. Konsentrasi EDTA dan garam
natriumnya yang dibutuhkan untuk mengomplekkan 1 ppm ion kalsium, ion
magnesium, dan ion barium.
|
Bahan pengomplek
|
Kelarutan g/100 ml H2O-79
0F
|
pH larutan air
|
Jumlah (ppm) yang
dibutuhkan untuk mengkomplekkan 1 ppm logam alkali tanah
|
||
|
Mg2+
|
Ca2+
|
Ba2+
|
|||
|
EDTA
|
0,02
|
2,3
|
12
|
7,4
|
2,1
|
|
Disodium etilen diamin tetra asetat dihidrat
|
11,1
|
5
|
15,4
|
9,5
|
2,7
|
|
Trisodium etilen diamin tetra asetat mono hidrat
|
57
|
8,4
|
15,6
|
9,6
|
2,8
|
|
Tetrasodium etilen diamin tetra asetat dihidrat
|
103,9
|
10,3
|
16,9
|
10,4
|
3
|
(Salimin,
2006)
2. Metalurgi
Dalam metalurgi, ekstraksi perak dan emas dengan
pembentukan senyawa kompleks siano dari bijihnya dan pemurnian logam nikel
menjadi senyawa kompleks karbonil merupakan contoh yang khas bagi manfaat
senyawa kompleks dalam proses ini. Dalam
bijih logam yang mengandung emas atau perak sekalipun kecil kadarnya, keduanya
dapat dipisahkan secara ekstraksi dengan larutan sianida dalam air yaitu dengan
membentuk senyawa kompleks yang larut.
4Au (s) + 8CN- (aq) +
O2 (g) +
2H2O
(l) --> 4[Au(CN)2]- (aq) +
4OH -(aq)
Selanjutnya ion kompleks ini dipisahkan dari
material-material tak larut yang lain dengan penyaringan (biasanya dengan
penambahan ion Na+),
kemudian ke dalam larutan senyawa kompleks ditambahkan logam elektropositif Zn
sehingga terjadi pemisahan emas:
2
[Au(CN)2]- (aq) +
Zn (s) --> [Zn(CN)4]- (aq) +
2 Au (s)
Metode distilasi fraksional yang sangat terkenal adalah
proses Mond (Ludwig Mond, 1839 - 1909 ahli kimia Inggris dari Jerman) untuk
pemurnian logam nikel. Gas
karbonmonoksida dialirkan lewat logam nikel yang tidak murni pada temperatur
sekitar 70 oC
sehingga terbentuk senyawa kompleks [Ni(CO)4] yang sangat volatil (mudah menguap, titik didih ≈ 43oC), tetapi
sangat beracun.
Ni (s) + 4
CO (g) --> [Ni(CO)4] (g)
Selanjutnya
senyawa kompleks ini dapat dipisahkan dari senyawa-senyawa lain yang lebih
sukar menguap dengan destilasi.
Pemanasan lebih lanjut senyawa kompleks ini pada 200 oC akan
diperoleh logam murni Ni, dan gas CO yang dibebaskan dapat dipakai ulang dalam
proses pengambilan logam Ni.
Ni(CO)4] (g) --> Ni (s) +
4 CO (g)
A. Dalam
kimia analitik
1. Analisis
Kualitatif
Pada
pemisahan dan pengenalan kation dalam bagan analisa kualitatif Ag+,
Pb2+, dan Hg22+ mula-mula diendapkan sebagai klorida.
Seluruh kation umum yang lain membentuk klorida yang dapat larut. PbCl2
(p) dipisahkan dari AgCl (p) dan HgCl2 (p) berdasar kelarutannya
yang lebih besar di dalam air panas. AgCl (p) dipisahkan dari Hg2Cl2
(p) berdasar kelarutannya dalam NH3 (aq).
Pada
bagian lain bagan analisis kualitatif diinginkan untuk mengendapkan CdS sebagai
Sulfida dengan penambahan Cu2+. Pada keadaan biasa, Cu2+
akan mengendapkan serentak dengan Cd2+, sebab Ksp untuk CuS lebih
kecil dari pada CdS. (6,3 x 10-36 dengan 8 x 10-27).
Tetapi dengan penambahan CN- berlebih sebelum penjenuhan dengan H2S,
pemisahan antara kedua kation terjadi, sesuai reaksi berikut :
Cd2+ + 4CN- → [Cd(CN)4]2- Kf = 7,1 x 1018
2Cu2+ + 10
CN- → 2 [Cu(CN)4]3- + C2N2
(g)
Reaksi
diatas merupakan rekasi oksidasi reduksi dimana Cu2+ direduksi
menjadi Cu+ dan terkompleks dengan CN-. Ion kompleks
[Cu(CN)4]3- sangat mantap, dimana nilai Kf adalah 1 x 1028.
Konsentrasi Cu+ bebas pada kesetimbangan dengan ion kompleks sangat
rendah. Jika suatu larutan yang mengandung ion kompleks ini dijenuhkan dengan H2S,
Ksp untuk Cu2S tidak tercapai. Sebaliknya, pada kondisi yang sama Cd2+]
pada kesetimbangan dengan [Cd(CN)4]2- cukup besar
sehingga Ksp CdS tercapai.
2. Penetuan
kesadahan air dengan Titrasi EDTA
Kesadahan
total yaitu ion Ca2+ dan Mg2+ dapat ditentukan melalui
titrasi dengan EDTA sebagai titran dan menggunakan indikator yang peka terhadap
semua kation tersebut. Kejadian total tersebut dapat dianalisis secara terpisah
misalnya dengan metode AAS (Automic Absorption Spectrophotometry).
Asam
Ethylenediaminetetraacetic dan garam sodium ini (singkatan EDTA) bentuk satu
kompleks kelat yang dapat larut ketika ditambahkan ke suatu larutan yang
mengandung kation logam tertentu. Jika sejumlah kecil Eriochrome Hitam T atau
Calmagite ditambahkan ke suatu larutan mengandung kalsium dan ion-ion magnesium
pada satu pH dari 10,0 ± 0,1, larutan menjadi berwarna merah muda. Jika EDTA
ditambahkan sebagai satu titran, kalsium dan magnesium akan menjadi suatu
kompleks, dan ketika semua magnesium dan kalsium telah manjadi kompleks,
larutan akan berubah dari berwarna merah muda menjadi berwarna biru yang
menandakan titik akhir dari titrasi. Ion magnesium harus muncul untuk
menghasilkan suatu titik akhir dari titrasi. Untuk mememastikankan ini,
kompleks garam magnesium netral dari EDTA ditambahkan ke larutan buffer.
Penentuan
Ca dan Mg dalam air sudah dilakukan dengan titrasi EDTA. pH untuk titrasi
adalah 10 dengan indikator Eriochrom Black T (EBT). Pada pH lebih tinggi, 12,
Mg(OH)2 akan mengendap, sehingga EDTA dapat dikonsumsi hanya oleh Ca2+
dengan indikator murexide. Adanya gangguan Cu bebas dari pipa-pipa saluran air
dapat di masking dengan H2S. EBT yang dihaluskan bersama NaCl padat
kadangkala juga digunakan sebagai indikator untuk penentuan Ca ataupun
hidroksinaftol. Seharusnya Ca tidak ikut terkopresitasi dengan Mg oleh karena
itu EDTA direkomendasikan. http://ginoest.wordpress.com
B. Bidang Kesehatan
3.
Terapi khelasi
Terapi
khelasi adalah metode pengobatan dengan menggunakan bahan utama EDTA (Ethylene
Diamine Tetracetik Acid ) dan nutrien lain yang dilarutkan dalam 500 ml larutan
infus steril, kemudian dimasukan ke dalam tubuh langsung melalui pembuluh darah
vena. Terapi khelasi berasal dari kata yunani “ CHELE “ yang berarti capit , sehingga
prinsip terapi khelasi ini adalah mencapit dimana yang dicapit disini adalah
logam-logam berat yang banyak masuk kedalam tubuh manusia karena berbagai
polusi seperti timah hitam, aluminium,merkuri,kadmium,dan bahan-bahan kimiawi
lainnya.
Polutan
tersebut dapat masuk kedalam tubuh kita dan beredar dalam pembuluh darah
melalui polusi asap industri, makanan modern seperti makanan kaleng,bahan
pengawet,bahan pewarna,bahan penyedap, dll. Terapi khelasi ini lebih bersifat
detoksifikasi atau menghilangkan dan menetralkan racun yang masuk kedalam tubuh
kita yang mengakibatkan proses atherosklerosis tersebut. Bahan – bahan polutan
dalam tubuh yang telah dicapit oleh EDTA akan dikeluarkan dari dalam tubuh
melalui ginjal sebagai urine dalam keadaan masih seperti aslinya tanpa
dimetabolisme. Keuntungan terapi khelasi :
Ø Memperbaiki
fungsi organ tubuh secara alamiah dengan membersihkan zat-zat beracun dari
dalam tubuh dan memperbaiki aliran darah.
Ø Memperbaiki
organ – organ secara menyeluruh tidak hanya satu organ saja
Ø Vitalitas
setelah khelasi meningkat
Ø Biaya
lebih ringan dibanding dengan operasi
Gambar 2. EDTA
http://askep-kesehatan.blogspot
1. Kompleks
kalsium disodium EDTA (CaNa2EDTA) sebagai pengikat logam timbal (Pb)
dalam tubuh manusia
Pengobatan
utama untuk orang-orang yang memiliki kadar timbal dalam darah cukup tinggi
atau yang memiliki gejala keracunan yaitu dengan terapi khelasi. Pengobatan
kekurangan zat besi, kalsium, dan seng yang diiringi dengan meningkatnya
penyerapan timbal, adalah bagian dari pengobatan untuk keracunan timbal. Ketika
bahan makanan yang mengandung timbal masuk kedalam saluran pencernaan
(dibuktikan dengan sinar-X), seluruh proses dalam usus, cathartics, endoscopi,
atau bahkan mungkin pembedahan digunakan untuk menghilangkannya dari usus dan
pencegahan penyebaran lebih lanjut. Jika terdapat timbal dalam otak Anticonvultans
dapat diberikan untuk mengendalikan kekejangan dan pengobatan untuk
mengendalikan pembengkakan otak termasuk kortikosteroid dan manitol. Pengobatan
keracunan timbal organic meliputi proses menghilangkan timbal dari kulit,
pencegahan penyebaran lebih lanjut, mengobati kejang dan mungkin terapi khelasi
untuk orang dengan konsentrasi timbal dalam darahnya tinggi dengan kadar timbal darah di atas 25 ug / dL
(Wikipedia, 2010).
Gambar
3. struktur CaNa2EDTA
Untuk
mengeluarkan Pb dari dalam tubuh maka tingkat ekskresi harus dinaikkan. Hal ini
dapat dilakukan dengan memberikan khelat. Zat khelat yang dipakai untuk
membuang logam beracun (timbal) dari dalam tubuh harus membentuk senyawa yang
stabil dengan ion logam tersebut. Adapun khelat yang cocok untuk digunakan
adalah Kalsium disodium EDTA (CaNa2EDTA) yang merupakan senyawa
kompleks. Zat pengkhelat ini hanya cocok untuk orang dewasa, sedangkan pada
anak-anak jarang digunakan zat ini. Di dalam tubuh, kalsium (Ca) akan
digantikan oleh timbal (Pb) karena bisa membentuk senyawa yang lebih stabil
dengan EDTA. Kalsium disodium EDTA (CaNa2EDTA) ini dalam bentuk
infus yang diberikan kepada penderita keracunan timbal (Pb). Faktor yang menentikan stabilitas kompleks adalah berdasarkan
pada sifat-sifat baik agen khelating dan logam khelat. Stabilitas konstan
kompleks dapat secara kuantitatif dinyatakan dalam nilai persamaan
kesetimbangan, yang tergantung pada struktur atom dari logam khelated. Sebagai contoh, konstanta stabilitas untuk logam
berbeda dengan EDTA berada pada skala yang ditunjukkan pada Tabel 1.
Tabel 1. Stabilitas logam terhadap EDTA
|
Metal
|
Na
|
Li
|
Ba
|
Sr
|
Mg
|
Ca
|
Mn
|
Fe
|
Co
|
Zn
|
Cd
|
Pb
|
Ni
|
|
K (log)
|
1,7
|
2,8
|
7,8
|
8,6
|
8,7
|
10,6
|
13,4
|
14,4
|
16,1
|
16,1
|
16,4
|
18,3
|
18,4
|
dimana
logam dengan k konstan yang lebih tinggi bersaing untuk agen chelating dengan
logam nilai stabilitas lebih rendah dan akhirnya menghapus kedua
Pemberian
kalsium disodium EDTA (CaNa2EDTA) yang akan mengkhelat timbal (Pb) dari
tulang dan jaringan lunak, sehingga membentuk ion kompleks PbNa2EDTA
yang stabil dan secara cepat juga akan diekskresikan melaui urin. CaNa2EDTA merupakan kompleks dan
Pb merupakan ion logam. Berdasarkan deret volta sifat reduktor Pb lebih kecil
dibandingkan dengan Ca. Hal ini berarti kemampuan oksidasi Pb lebih kecil
dibandingkan dengan Ca sehingga posisi Ca di EDTA akan digantikan oleh Pb.
Sehingga Pb2+ akan berikatan dengan Na2EDTA dan terbentuk
kompleks PbNa2EDTA yang stabil . Akibatnya Pb akan keluar dalam
bentuk larutan berupa air seni. Sedangkan Ca2+ akan tertinggal dalam
tubuh sebagai zat gizi. Jadi kompleks kalsium disodium EDTA (CaNa2EDTA)
dapat digunakan sebagai pengikat logam timbal (Pb) dalam tubuh manusia sehingga
timbal (Pb) yang bersifat racun dapat keluar dari dalam tubuh manusia tersebut. Pertukaran tersebut terjadi sebab [Pb Na2(EDTA)]
(Kf = 1 x 1018) lebih mantap dibanding [Ca Na2(EDTA)]2-
(Kf = 4 x 1010).
Pb2+
+ [CaNa2(EDTA)] → [PbNa2(EDTA)] + Ca2+
Derajat kemantapan yang
tinggi dari kompleks EDTA dan beberapa lainnya dapat dijelaskan dengan adanya
cincin kelat beranggotakan lima dalam kompleks tersebut (Flora, 2010).
1. EDTA
sebagai antikoagulan
Dalam
dunia kedokteran darah sangat diperlukan untuk pemeriksaan penyakit secara medis.
Darah cepat membeku, oleh karena itu diperlukan suatu zat yang dapat membuat
darah tidak membeku untuk mempermudah pemeriksaan secara labororium. Antikoagulan
adalah zat yang mencegah penggumpalan darah dengan cara mengikat kalsium atau
dengan menghambat pembentukan trombin yang diperlukan untuk mengkonversi
fibrinogen menjadi fibrin dalam proses pembekuan . Jika tes membutuhkan darah
atau plasma, spesimen harus dikumpulkan dalam sebuah tabung yang berisi
antikoagulan. Spesimen-antikoagulan harus dicampur segera setelah pengambilan
spesimen untuk mencegah pembentukan microclot. Pencampuran yang lembut sangat
penting untuk mencegah hemolisis.
Ada
berbagai jenis antikoagulan, masing-masing digunakan dalam jenis pemeriksaan
tertentu. Umumnya tersedia dalam bentuk garam sodium (natrium) atau potassium
(kalium), mencegah koagulasi dengan cara mengikat atau mengkhelasi kalsium.
EDTA memiliki keunggulan disbanding dengan antikoagulan yang lain, yaitu tidak
mempengaruhi sel-sel darah, sehingga ideal untuk pengujian hematologi, seperti
pemeriksaan hemoglobin, hematokrit, KED, hitung lekosit, hitung trombosit,
retikulosit, apusan darah, dsb. K2EDTA biasanya digunakan dengan
konsentrasi 1 - 1,5 mg/ml darah. Penggunaannya harus tepat. Bila jumlah EDTA
kurang, darah dapat mengalami koagulasi. Sebaliknya, bila EDTA kelebihan,
eritrosit mengalami krenasi, trombosit membesar dan mengalami disintegrasi.
Setelah darah dimasukkan ke dalam tabung, segera lakukan
pencampuran/homogenisasi dengan cara membolak-balikkan tabung dengan lembut
sebanyak 6 kali untuk menghindari penggumpalan trombosit dan pembentukan bekuan
darah. http://labkesehatan.blogspot.com/2009/11/antikoagulan.html
I.
REFERENSI
Aksep,
2008. Terapi Khelasi. http://askep-kesehatan.blogspot.com
(diakses 4 agustus 2010).
Flora,
J.s. and Pachauri, V., 2010. Chelation in Metal Intoxication. International Journal of Enviromental
Research and Public Health 7 :
2745-2788, 2010.
Ginoest.
2010. Penentuan Kesadahan air dengan
titrasi EDTA. http://ginoest.wordpress.com/2010/03/23/17. (diakses 4
agustus 2010)
Keenan,
dkk., 1992. Ilmu Kimia untuk Universitas.
Erlangga : Jakarta.
Laboratorium
Kesehatan. 2009. Antikoagulan. http://labkesehatan.blogspot.com.
Oxtoby, dkk.,
2003. Prinsip-Prinsip Kimia Modern.
Erlangga : Jakarta.
Petrucci,
R.H., 1987. Kimia Dasar Prinsip dan Terapan
Modern ed IV jilid 3. Erlangga : Jakarta.
Wikipedia, 2010. Lead
Poisoning. http://en.wikipedia.org/wiki/Lead_poisoning#Treatment (diakses
tanggal 3 Agustus 2010)







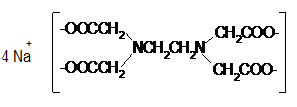



1 komentar:
bisa ga ngejelasin kelat itu apa? masih ngawang-ngawang dengan kelat itu sendiri, makasih
Posting Komentar